Во время оперативных вмешательств возможны нарушения в работе электрокардиостимулятора (ЭКС). С помощью математического моделирования, экспериментального и клинического исследований проведена оценка безопасности оперативных вмешательств у пациентов с ЭКС. Установлены опасность, клиническая значимость и методы профилактики нарушений работы ЭКС во время оперативных вмешательств. Для прогнозирования нарушений и минимизации их клинических последствий целесообразны выполнение предоперационной проверки системы ЭКС с коррекцией программы устройства, применение безопасной методики оперативного вмешательства, контроль сердечной деятельности и возможность консультации интраоперационной ситуации специалистом-аритмологом. Операции у пациентов с ЭКС требуют комплекса мер, направленных на обеспечение их безопасности.
Ключевые слова: электрохирургические вмешательства, нарушение работы электрокардиостимулятора.
Electrocardiostimulator (ECS) disturbances may occur during surgical interventions. By applying mathematical simulation, the experimental and clinical studies evaluated the safety of surgical interventions in patients with ECS. The hazard and clinical value of ECS disturbances and methods for their prevention during surgery were established. To predict disturbances and to minimize their clinical con- sequences, it is expedient to preoperatively check an ECS system and to correct the latter, to use a safety surgical procedure, to monitor cardiac performance, and, if possible, to consult an arrhythmologist about the intraoperative situation. Operations performed in patients with ECS call for a package of measures to assure their safety.
Key words: electrosurgical interventions, electrocardiostimulator disturbance.
Наличие у хирургического пациента электро- кардиостимулятора (ЭКС) или кардиовертера- дефибриллятора (ИКД) до настоящего времени ставит перед врачами, принимающими участие в лечении, вопрос о безопасности электрохирургических вмешательств (ЭХВ) с использованием монополярной электрокоагуляции (МЭК) [6, 25]. Установлено, что при использовании электрохирургического оборудования в работе ЭКС могут возникать нарушения. Публикации по данной проблеме в зарубежной литературе достаточно многочисленны как в виде клинических случаев, так и национальных рекомендаций [3, 10, 12, 15, 18, 21, 24, 25]. В них приведены описания опасности и осложнений, мер профилактики нарушений работы ЭКС, действий хирургов и анестезиологов на этапах лечебного процесса. Описаны такие нарушения, как ингибирование стимуляции, перепрограммирование ЭКС, температурное повреждение ткани сердца в зоне электродов ЭКС, полный отказ устройства [8, 9, 11, 13, 16, 19, 23, 26]. Механизм большинства перечисленных нарушений известен. В то же время детализация некоторых вопросов недостаточна, например: не установлена частота развития нарушений работы ЭКС, дискутабельны вопросы выбора оптимальных параметров и режимов стимуляции, мало конкретной информации об описанном в литературе температурном повреждении сердечной ткани в зоне электродов ЭКС и др. Отечественные публикации об операциях у больных с ЭКС единичны, при том что проблема может иметь в том числе и национальные особенности. Помимо ЭКС известных брендов в России в настоящее время проводят имплантации более 20 моделей ЭКС отечественного производства [1]. С целью повышения безопасности ЭХВ у пациентов с ЭКС проведено клинико-экспериментальное исследование.
Материалы и методы
В зависимости от вида и частоты нарушения сердечного ритма, физической активности пациента и других факторов применяют несколько режимов электростимуляции сердца. Для удобства обозначения конкретного варианта ритмовождения используют аббревиатурный код. Первая буква кода обозначает стимулируемую камеру сердца (V – ventricle, A – atrium, D – dual – двухкамерная стимуляция). Вторая буква указывает камеру сердца, откуда воспринимается управляющий сигнал (V – ventricle, A– atrium, D– dual, О– сигнал не воспринимается ни одной из камер). Третья буква характеризует режим, в котором аппарат реагирует на спонтанную электрическую активность сердца (I – inhibited – запрещаемый, T – triggered – триггерный, D – dual – запрещаемый и триггерный, О – отсутствие способности воспринимать сигналы и реагировать на них). Чаще всего используют режимы VVI (стимуляция правого желудочка), AAI (стимуляция правого предсердия), DDD (двухкамерная стимуляция). У пациентов с хронической недостаточностью кровообращения на фоне нарушения внутрисердечной проводимости применяют трёхкамерные режимы. Как правило, работа устройств синхронизирована с сердечной деятельностью – используют режим «деманд», обеспечивающий прекращение стимуляции при восстановлении собственного сердечного ритма. Асинхронные режимы (А00, V00, D00 стимуляция) применяют редко [2, 4, 9].
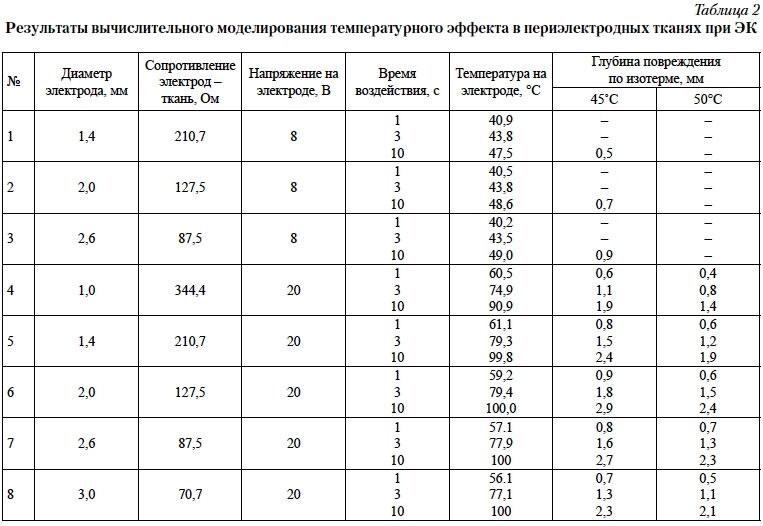
Первый этап – имитационное моделирование резистивного нагрева миокарда в зоне электродов ЭКС высокочастотными токами электрокоагулятора (ЭК). Произведён расчёт напряжённости электрического поля и напряжения на электроде ЭКС. Глубина температурного повреждения сердца оценена в зависимости от переменных показателей: продолжительности воздействия, диаметра электрода ЭКС, мощности МЭК воздействия, сопротивления тканей с помощью программы в среде MathCAD. Необратимо повреждёнными считали ткани миокарда, температура в которых достигала 50°С, развитие функциональных нарушений – 45°С [17, 20].
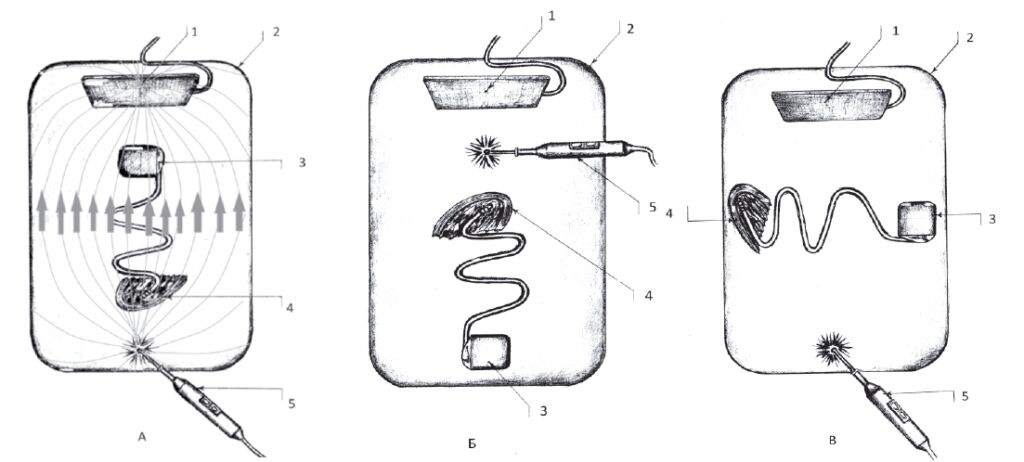
Второй этап – температурный эффект в пери- электродных тканях исследован в ходе стендовых испытаний, моделирующих ЭХВ у пациентов с ЭКС. В ёмкость с электролитом (0,35% NaCl с удельной токопроводностью 0,77 См/м) помещали фрагмент сердца быка с установленным ЭКС. К дистальному полюсу электрода ЭКС фиксировали термопару, подключённую к термометру с высокой разрешающей способностью и скоростью измерений. Использовали «коагуляцию», «резание», «спрей» в монополярном режиме мощностью от 50 до 300 Вт, продолжительностью от 1 до 10 с, на расстоянии от 0 до 20 см от устройства. Исследованы 3 варианта расположения системы стимуляции по отношению к электродам ЭК (рис. 1А, 1Б, 1В). Расположение электродов, указанное на рис. 1А, не рекомендуется к использованию в клинической практике [7, 12, 22] – эффект ЭХВ на систему ЭКС максимален из-за совпадения ориентации силовых линий тока ЭК и оси «дистальный полюс электрода – ЭКС». Такая позиция создаётся при операции на органах брюшной полости с пассивным электродом под лопаткой или операции в зоне ЭКС (дельтоидеопекторальная область) с электродом под ягодицей. Расположение системы стимуляции, представленное на рис. 1Б и 1В, менее опасно, так как указанные оси перпендикулярны (проекция силовых линий тока ЭК на ось «электрод – ЭКС» равна 0) (рис. 1В) или система стимуляции располагается вне зоны высокой напряженности электрического поля (рис. 1Б).
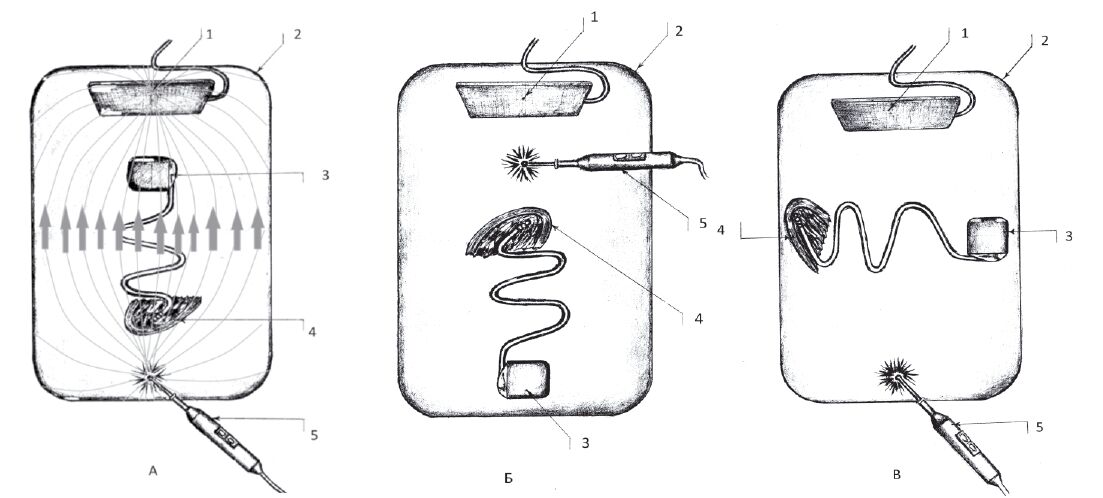
Для оценки влияния ЭК на имплантированную систему стимуляции выполнен эксперимент на 3 трупах, в ходе которого после имплантации устройства проводили воздействие с замером температурного эффекта в периэлектродных тканях и сопротивления электродов.
Завершающий этап – оценка работы ЭКС во время оперативных вмешательств с использованием МЭК. За период с 2001 по 2012 г. 254 пациентам в возрасте от 52 лет до 91 года выполнены 274 оперативных вмешательства, из которых 195 – общехирургические операции (расстояние от зоны операции до ЭКС – 15 см), 79 – операции в зоне ЭКС (< 15 см).
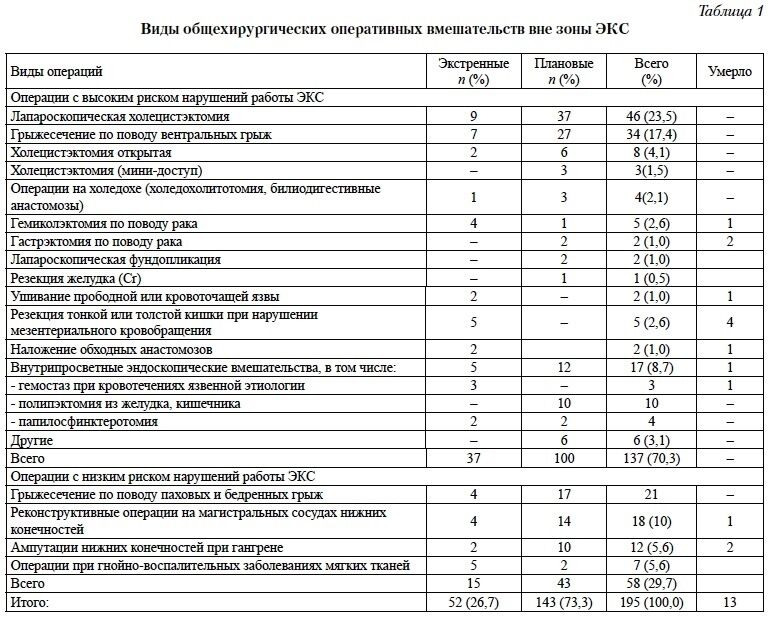
Операции вне зоны ЭКС (общехирургические вмешательства), среди которых выделены вмешательства высокого и низкого рисков развития нарушений работы ЭКС (табл. 1), выполнены 175 пациентам. В этой группе у 98 (56,0%) пациентов функционировали импортные системы стимуляции, из которых у 55 (31,4%) – двухкамерные, 43 (24,6%) – однокамерные устройства. У 77 (44,0%) были имплантированы отечественные ЭКС, из них двухкамерное устройство – 1.
Операции в зоне ЭКС (n = 79) выполнены по поводу нарушений работы ЭКС (n = 35) или нагноений в зоне устройства (n = 44) в условиях специализированной рентгеноперационной. При чистых вмешательствах проводили смену ЭКС или электродов, при лечении гнойных осложнений выполняли хирургическую обработку или деимплантацию устройства. В этой группе у 55 (69,6%) пациентов функционировали импортные устройства, у 24 (30,4%) – отечественные.
Для рассечения тканей и гемостаза использовали МЭК мощностью от 40 до 150 Вт в режимах «спрей», «резание», «коагуляция» с безопасной ориентацией электродов ЭК: при операциях на брюшной полости и конечностях пассивный электрод ЭК располагали под ягодицей, при вмешательствах в зоне ЭКС (дельтоидеопекторальная область) – под плечом на стороне операции.
Контроль сердечной деятельности проводили по кардиомонитору. У 18 пациентов дополнительно оценивали внутрисердечную электрограмму по программатору ЭКС. Для ретроспективной оценки работы сердца и ЭКС 24 пациентам проведено мониторирование ЭКГ методом Холтера. Для оценки возможного повреждающего действия МЭК на сердечную ткань в зоне электродов ЭКС исследовали уровень кардиотропных ферментов и анализировали динамику ЭКГ на 1-е и 3-и сутки после операции у 21 пациента.
В завершении клинического этапа провели патоморфологическое исследование трупов пациентов, умерших после перенесённых оперативных вмешательств.
Кроме того, в работу включено 2 наблюдения нарушения работы ЭКС при электрической дефибрилляции в ходе сердечно-лёгочной реанимации.
Сравнение различий результатов выполняли при помощи t-критерия Стьюдента (Вилкоксона). Вероятность р < 0,05 считали достаточной для вывода о достоверности различий между группами. При значении р > 0,05 различия между величинами расценивали как статистически недостоверные.
Результаты исследования
Математическое моделирование позволило сделать вывод о значительном температурном эффекте в периэлектродных тканях при ЭК. Обратимость и глубина повреждения зависели в первую очередь от напряжения и времени воздействия (табл. 2), в меньшей степени – от диаметра контактной части дистального полюса электрода ЭКС.
В результате стендовых испытаний выявили нагрев тканей в зоне дистального полюса эндокардиальных электродов при применении различных режимов ЭХВ. При использовании «опасных» режимов ЭХВ, т. е. при расположении системы ЭКС параллельно силовым линиям тока на расстоянии 100 мм от обоих электродов ЭК, зафиксировали повышение температуры (∆t) от 0,1 до 6,4°С (табл. 3).
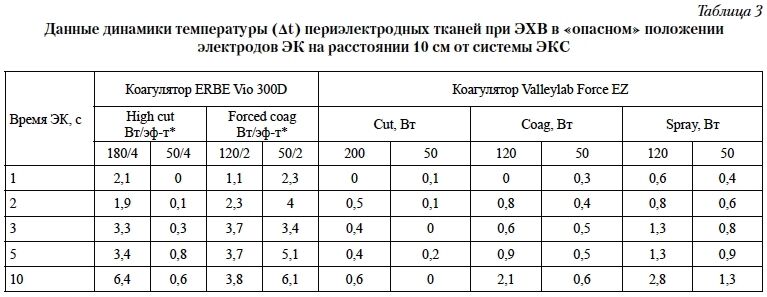
электродов ЭК на расстоянии 10 см от системы ЭКС
Результат зависел от модели ЭК, режима, мощности и продолжительности ЭХВ (р < 0,05). При приближении активного электрода ЭК к зоне фиксации эндокардиального электрода в ткани сердца или к корпусу ЭКС на расстояние менее 5 см вокруг дистального полюса электрода наблюдали формирование венчика белесых тканей глубиной до 2 мм (рис. 2) с повышением температуры периэлектродных тканей на 20–40°С.
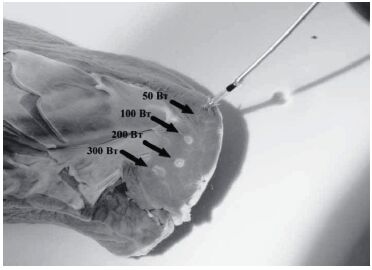
При ЭХВ в безопасной позиции на расстоянии более 20 мм от дистального полюса эндокардиального электрода даже при максимальной мощности и продолжительности 10 с температурный эффект отсутствовал (∆t ≤ 0,1°С). При использовании режима «спрей» на расстоянии 20 мм в течение 10 с установлен нагрев электрода на 1,1°С даже при безопасном положении электродов ЭК. Похожий незначительный эффект (0,1–0,5°С) наблюдали при ЭХВ на расстоянии от 20 до 5 мм от корпуса ЭКС, что объясняется особенностями распространения электрического тока в непосредственной близости от электродов ЭК (рис. 1А). Таким образом, расчётные данные и результаты стендовых испытаний подтвердили принципиальную возможность нагрева периэлектродных тканей при МЭК с зависимостью эффекта от расположения электродов, расстояния до устройства и мощности воздействия.
В эксперименте на трупах повышения температуры при воздействии на любом расстоянии от ЭКС не зафиксировано. Значительный температурный эффект наблюдали только при прямом контакте с металлическим проводником электрода и корпусом ЭКС, он составил соответственно 78,9 ± 20,4 и 36,8 ± 10,7°С с повышением сопротивления электрода с 680 до 1 100 Ом и с 353 до 410 Ом.
На клиническом этапе у большинства пациентов во время операции регистрировали нормальную работу ЭКС. У ряда моделей наблюдали некоторые особенности функционирования, определявшиеся программой устройств. Например, при активированной функции «режим сна», которой оснащены большинство импортных устройств, частота стимуляции снижалась до 50 ударов в минуту, что, как правило, вызывало беспокойство анестезиологов.
Нарушения работы ЭКС в ходе 195 общехирургических вмешательств были зафиксированы у 14 (8,0%) из 175 пациентов, из них у 13 (7,4%) – при использовании МЭК.
Все нарушения наблюдали во время вмешательств «высокого риска развития нарушений работы ЭКС»:
- при холецистэктомии (n = 57) – у 8 (14,0%),
- при грыжесечениях по поводу вентральных грыж верхнего этажа брюшной полости (n = 34) – у 4 (11,8%),
- при гастрэктомии – у 1.
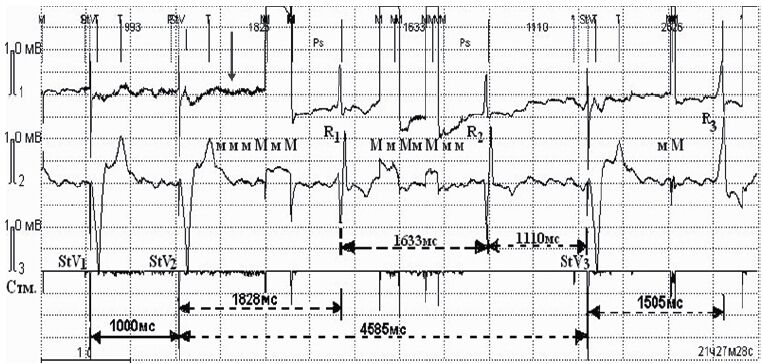
У 9 (5,1%) пациентов в момент ЭК наблюдали эпизодическое подавление стимулов (ингибирование) ЭКС. На рис. 3 первые два желудочковых комплекса навязаны ЭКС (StV1, StV2). После StV2 на фоне ЭК на протяжении 4 585 мс стимулы ЭКС отсутствуют, а желудочковые комплексы R1 и R2, возникающие через 1 828 и 1 633 мс, являются собственными желудочковыми сокращениями с частотой ритма 35 уд/мин (интервалы отмечены пунктирными стрелками). Нарушение зарегистрировано у 8 пациентов в монополярном режиме чувствительности ЭКС и у 1 – в биполярном.
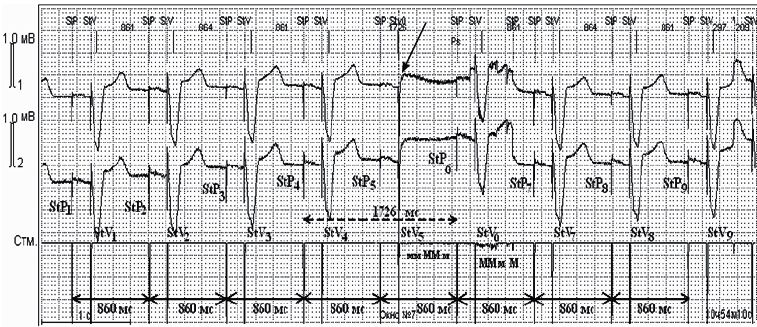
Единичные неэффективные стимулы ЭКС во время ЭК были выявлены у 1 (0,6%) пациента. На рис. 4 – двухкамерный режим стимуляции DDD. StР1- StР9 – эффективные предсердные стимулы. StV1–StV4, StV6–StV9 – эффективные желудочковые стимулы. Желудочковый StV5 не вызывает деполяризации миокарда (пауза длительностью 1 726 мс).
У 2 (1,1%) пациентов под воздействием ЭК был зарегистрирован временный переход ЭКС из исходно запрограммированного режима VVI в асинхронный режим стимуляции (VOO) (рис. 5), вследствие чего стимуляция продолжалась (St V1– StV7) несмотря на достаточную частоту собственных сокращений сердца (R1 – R8). Также у 1 (0,6%) пациента наблюдали кратковременное изменение режима стимуляции с DDD на DDI вследствие активации антитахикардитической функции (АMS – Auto Mode Switch) под воздействием ЭК с уменьшением частоты стимуляции со 120 до 80 уд/мин.
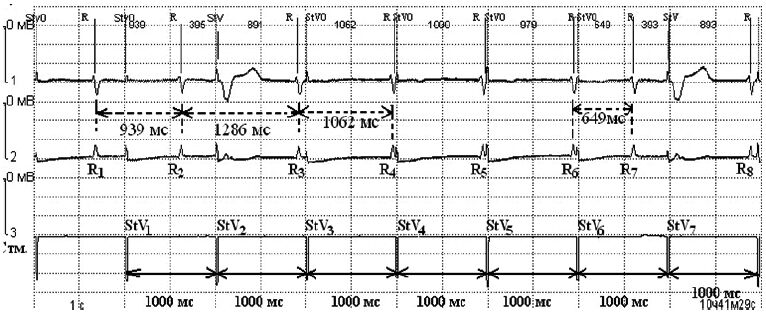
Описанные нарушения регистрировали не посредственно в момент ЭК-воздействия. Послеоперационная проверка системы ЭКС не выявила нарушений или изменений программы.
При операциях в зоне ЭКС ингибирование стимуляции наблюдали у 2 (2,5%) пациентов. В этой группе отмечали единственный случай необратимого повреждения устройства при удалении атеромы зоны ложа ЭКС, выполняемой симультанно при смене эндокардиального электрода по поводу повышения порога стимуляции. Вмешательство осуществляли в условиях специализированной аритмологической операционной. После удаления атеромы, интимно прилежащей к электроду ЭКС, зафиксировали прекращение стимуляции, потребовавшее смены устройства (рис. 6).
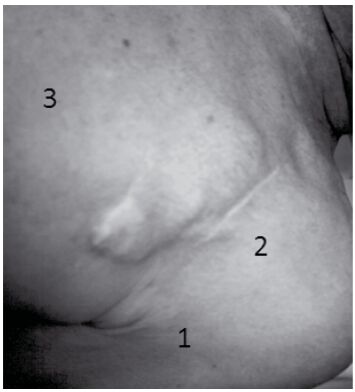
2 – через кожу контурируется эндокардиальный электрод, который располагается непосредственно по верхнему контуру атеромы; 3 – ЭКС
Полное прекращение стимуляции наблюдали ещё у 2 пациентов при наружной электрической дефибрилляции, выполняемой по поводу желудочковой тахикардии, развившейся при экстренной имплантации ЭКС. У обоих пациентов проведена успешная смена ЭКС, из них у одного выявлено повышение порога стимуляции с 0,4 до 1,1 В а после операции – до 2,2 В. Все случаи полного отказа ЭКС были зафиксированы у пациентов с устройствами отечественного производства. При остальных нарушениях какие-либо вмешательства в систему стимуляции не требовались.
Уровень кардиотропных ферментов у большинства пациентов сохранялся в нормальных пределах. Только в одном случае на 1-е сутки после операции выявлено повышение КФК без динамики МБ-фракции.
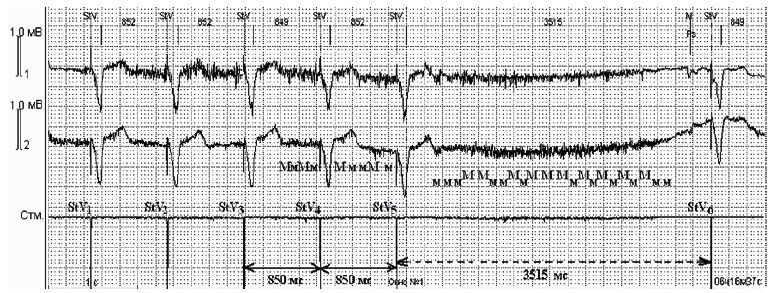
Следует отметить одно (0,6%) наблюдение нарушения работы устройства, функционирующего в монополярном режиме чувствительности, вследствие миопотенциального ингибирования, не связанного с ЭК. Это нарушение является следствием гиперчувствительности ЭКС, в связи с чем устройством воспринимаются биоэлектрические потенциалы поперечно-полосатой мускулатуры при движении или изменении мышечного тонуса.
На рис. 7 представлена картина миопотенциального ингибирования: между стимулами StV5 и StV6 – пауза продолжительностью 3 515 мс. Причиной асистолии явились биопотенциалы поперечно-полосатой мускулатуры (Мм).
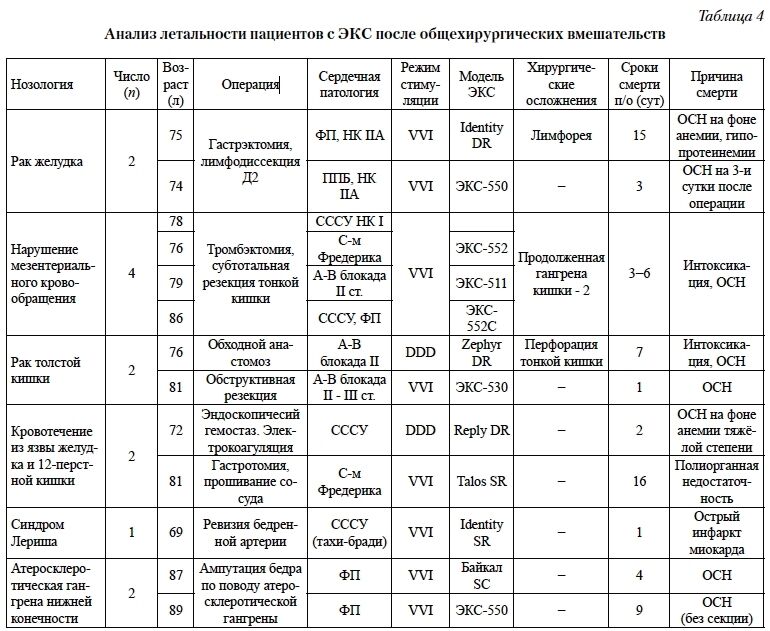
В группе общехирургических вмешательств (вне зоны ЭКС) умерло 13 (7,4%) пациентов (табл. 4), из них большинство – 11 пациентов – после экстренных или срочных операций. Средний возраст умерших пациентов 78,7 ± 6,0 года. Сроки смерти после операции составили от 1 до 15 суток.
Патолого-анатомическое исследование ткани сердца в зоне фиксации эндокардиальных электродов как при макроскопическом, так и при гистологическом исследовании также не обнаружило признаков термического повреждения (рис. 8А, 8Б). После вмешательств в зоне ЭКС смертельных исходов не было.
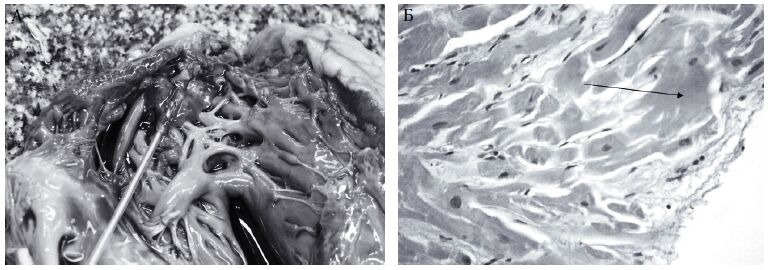
Рис. 8 Б. Микропрепарат миокарда правого желудочка сердца в области фиксации электрода пациента, умершего в течение 1-х суток после вмешательства по поводу острого нарушения мезентериального кровообращения. Имеются деструкция эндокарда, интерстициальный отёк и очаговое повышение сорбции красителя цитоплазмой кардиомиоцитов вследствие механической травмы при имплантации электрода. Признаки термического поражения отсутствуют. Ув. x 400. Окраска гематоксилином и эозином
Обсуждение результатов
Представления о проблеме операций у пациентов с ЭКС чаще всего основаны на клинических наблюдениях и описаниях небольших групп пациентов. Крупных рандомизированных исследований не проводили [22]. Частота нарушений работы ЭКС при ЭХВ достоверно не установлена. С 1984 по 1997 г. в США зарегистрировано 255 нарушений в работе ЭКС и ИКД, связанных с применением ЭК [15].
На основе данных литературы и нашего исследования систематизировали нарушения в работе ЭКС во время хирургических вмешательств:
I. Нарушения, не связанные с электрокоагуляционным воздействием
Миопотенциальное ингибирование.
II. Нарушения, связанные с электрокоагуляционным воздействием
1. Ингибирование стимула ЭКС [15, 24].
2. Температурное воздействие на ткань сердца в зоне электродов ЭКС с развитием неэффективной стимуляции [9, 13].
3. Провокация желудочковых или суправентрикулярных нарушений сердечного ритма [25].
4. Включение асинхронного режима стимуляции [15, 16].
5. Изменение программы ЭКС [13, 19].
6. Полный отказ ЭКС [8, 11].
III. Нарушения при электрической дефибрилляции
1. Повышение порога стимуляции.
2. Полный отказ ЭКС.
Особенностью современных ЭКС является их способность воспринимать электрическую активность сердца и прекращать стимуляцию при увеличении частоты спонтанного сердечного ритма выше запрограммированной. Высокочастотные помехи во время ЭХВ могут ошибочно детектироваться ЭКС как частая деятельность сердца. В соответствии с программой ЭКС это приводит к прекращению стимуляции. В таком случае у стимуляторозависимых пациентов наблюдается асистолия или редкий замещающий сердечный ритм. У стимуляторонезависимых больных клинические последствия остановки стимуляции менее значительны – как правило, восстанавливается сердечная деятельность с приемлемой частотой [13, 15, 23, 24]. Необходимо отметить, что ингибирование работы ЭКС чаще всего встречалось у пациентов с устаревшими моделями отечественных аппаратов с монополярной конфигурацией системы стимуляции. В связи с этим при наличии у стимуляторозависимых (!) пациентов такого устройства перед предполагаемым оперативным вмешательством целесообразен перевод режима стимуляции в асинхронный. У пациентов с достаточной частотой собственного ритма такое изменение программы нецелесообразно, так как возможна «конкуренция ритмов» с нежелательными гемодинамическими эффектами и угрозой индукции фатальных желудочковых тахикардий. В биполярном режиме чувствительности вероятность ингибирования устройства значительно меньше, мы располагаем единственным наблюдением.
В рекомендациях Американской ассоциации сердца/Американского колледжа кардиологов (AHA/ACC) 2007 г. повреждение сердца в зоне электродов ЭКС рассматривается в качестве возможных осложнений ЭХВ [7]. Полученные данные указывают на возможность термического повреждения сердечной ткани при ЭХВ, в первую очередь при ориентации силовых линий тока ЭК по оси «электрод – корпус ЭКС» (опасное положение) и приближении зоны ЭХВ к устройству. В эксперименте при воздействии на расстоянии менее 50 мм от дистального полюса электрода ЭКС температура периэлектродных тканей может достичь температуры кипения, а глубина необратимого повреждения – более 2 мм. Категорически недопустим контакт электрохирургического инструмента с корпусом ЭКС – эффективное напряжение в этом случае может составить несколько десятков вольт, а эффект – превысить температуру необратимого повреждения ткани сердца (50°С). В то же время уже при 45–48°С наблюдаются функциональные нарушения в клетках от деполяризации потенциала покоя до обратимой потери возбудимости [17]. Возможно, этим объясняются эпизоды неэффективной стимуляции, зафиксированные на рис. 4. В эксперименте на трупах температурный эффект не подтверждён, в связи с чем результаты стендового эксперимента следует трактовать как возможные в клинической практике в условиях идеальной электропроводности. В результате патолого-анатомического исследования температурного повреждения периэлектродных тканей не установили ни в одном наблюдении (рис. 8А, 8Б).
Переход ЭКС в асинхронный режим стимуляции под воздействием ЭК с «конкуренцией» навязанного и спонтанного ритмов сердца не является результатом перепрограммирования ЭКС.
Изменение режима определено программой помехоустойчивости ЭКС вследствие перезапуска его рефрактерного периода как защита от асистолии. Такой вариант ответа на высокочастотные помехи ЭК потенциально опасен у пациентов с преобладающей высокой частотой собственного сердечного ритма (стимуляторонезависимые пациенты) с развитием «конкуренции ритмов» [15]. Опасность данного нарушения заключается в развитии фатальных желудочковых нарушений сердечного ритма при попадании стимула ЭКС в «уязвимую фазу» собственного желудочкового комплекса [26]. Необходимо отметить, что благодаря программированию в настоящее время низких значений амплитуды, длительности стимула, а также кратковременности данных нарушений вероятность возникновения таких аритмий скорее гипотетическая.
Феномен миопотенциального ингибирования хорошо изучен аритмологами [1], но, как нарушение в работе ЭКС во время оперативных вмешательств, не описан. Данное проявление гиперчувствительности необходимо прогнозировать при предоперационной проверке ЭКС, а при его регистрации – перепрограммировать чувствительность стимулируемой камеры ЭКС на более грубую или в биполярную конфигурацию [3].
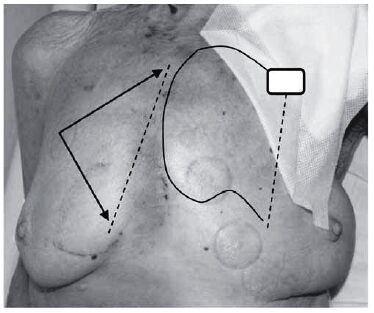
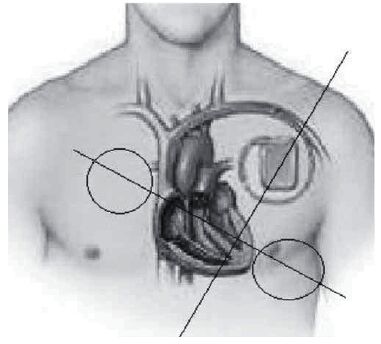
Наблюдения полного отказа ЭКС во время ЭХВ единичны за всю историю электрокардиостимуляции [11]. Наше наблюдение отказа работы ЭКС при ЭХВ в непосредственной близости от устройства требует рекомендовать проведения таких вмешательств только в условиях специализированной операционной с возможностью его смены или проведения временной электрокардиостимуляции. Для уменьшения риска нарушения работы ЭКС при электрической дефибрилляции у пациентов с ЭКС, как и при ЭК, необходима правильная ориентация электродов дефибриллятора по отношению к оси «электрод – ЭКС» (рис. 9, 10).
Для адекватной оценки интраоперационной аритмологической ситуации хирург и анестезиолог должны отслеживать соответствие характеристик сердечного ритма запрограммированным параметрам стимуляции, которые в ходе вмешательства, как правило, не меняются. На большинство вопросов о модели, особенностях программы и параметрах стимуляции позволяет ответить предоперационная проверка ЭКС. В предоперационном периоде целесообразно выделить следующие задачи обследования и коррекции программы ЭКС.
1. Оценка основных параметров стимуляции: режима (AAI, VVI, DDD и т. д.), амплитуды, длительности импульса, порога стимуляции, полярности стимулирующего импульса и воспринимаемого сигнала, частоты магнитного теста, состояния батареи и электродов.
2. Коррекция программы ЭКС с целью выключения функций, которые могут вносить изменения в штатный режим стимуляции во время определённых этапов операции: выключение функции сенсора, автоматического определения порога стимуляции, функции сна, гистерезиса по частоте.
3. Определение стимуляторозависимости пациентов.
4. Коррекция программы с целью предупреждения нарушений в системе стимуляции: перепрограммирование предсердной/желудочковой чувствительности с моно- на биполярную (большинство моделей). При невозможности – программирование в режим низкой чувствительности, а у стимуляторозависимых пациентов – режима стимуляции на асинхронный.
5. Выключение функции дефибрилляции у пациентов с имплантированными ИКД.
6. При выявлении перед операцией ситуаций, не устранимых программированием, проведение хирургической коррекции.
Для обеспечения безопасности ЭХВ у пациентов с ЭКС целесообразно соблюдение следующих правил:
• недопустимо расположение системы стимуляции между электродами ЭК с совпадением ориентации силовых линий электрического поля и оси «электрод – ЭКС»;
• во время ЭХВ целесообразно использование минимальной эффективной мощности. При воздействии мощностью, превышающей 50 Вт, значительно увеличивается риск развития температурного эффекта в зоне электродов;
• из соображений профилактики асистолий из-за возможного ингибирования устройства целесообразно ограничение времени однократного воздействия 3 с. Кроме того, в эксперименте за 3-секундный интервал ЭК-воздействия нагрев тканей не превысил 3,6°С, т. е. с двухкратным запасом до температуры обратимого повреждения тканей – 45 °С;
• использование ЭХВ в зоне ЭКС требует особой осторожности из-за риска контакта с корпусом аппарата или участком электрода с повреждённой изоляцией. ЭХВ в зоне дистального полюса электрода могут сопровождаться нагревом периэлектродных тканей с повышением порога стимуляции и развитием неэффективной стимуляции.
Следует отметить, что у пациентов с ИКД на время операции следует отключать функции дефибрилляции, так как детекция коагуляционных помех этими устройствами может привести к нанесению немотивированного разряда с запрограммированной мощностью (как правило, более 20 Дж), опасного в том числе для персонала [10].
Выводы
1. Наличие ЭКС при ЭХВ требует строгого соблюдения правил безопасности – при операциях в работе ЭКС могут наблюдаться нарушения, связанные с воздействием электрокоагуляции или особенностями работы устройств в конкретных условиях. В большинстве случаев нарушения носят кратковременный преходящий характер и не представляют непосредственной угрозы жизни пациентов.
2. При электрическом воздействии в непосредственной близости от устройства риск нарушений работы устройства, в том числе полного выхода из строя, увеличивается, что требует проведения таких вмешательств только в условиях специализированной операционной.
3. Для профилактики и своевременной диагностики нарушений целесообразны выполнение проверки системы ЭКС с коррекцией программы, контроль сердечной деятельности в ходе вмешательств, во время операций – обеспечение возможности консультации интраоперационной ситуации специалистом-аритмологом.
Литература
1. Бокерия Л. А., Ревишвили А. Ш., Дубровский И. А. и др. Состояние электрокардиостимуляции в России в 2008 г. // Вестн. аритмологии. – 2010. – № 59. – С. 5–10.
2. Плюскин Б. И., Погребченко В. И. Особенности лечения холедохолитиаза у престарелой больной с искусственным водителем сердечного ритма // 1-й международный славянский конгресс по электрокардиостимуляции и клинической электрофизиологии сердца. Сборник тезисов. – СПб., 1994. – С. 67–68.
3. Руководство фирмы St. Jude по эксплуатации программатора APSIII, кардиостимуляторов Affinity D. R., Trilogy S. R. [Электронный ресурс]: Электрон. данн. Режим доступа: http://www.medwow.com/med/ pacemaker/pacesetter/trilogy-dr-2350/21992.model- specсвободный. – Загл. с экрана. Яз. англ. (дата обращения 1.02.2012).
4. Савинский Г. А., Мосунов А. И., Суханов Ю. А. Особенности ургентной хирургической патологии у больных с постоянными ритмоводителями сердца // Актуальные вопросы электрокардиостимуляции. – Томск. – 1983. – Тез. докл. Всесоюзной конференции. – С. 74.
5. Садовой Н. П., Долматов Е. А. Реконструктивные сосудистые операции у больных с генерализованным атеросклерозом и искусственным водителем ритма // Тез. докл. Всесоюзной ангиологической конференции. Актуальные вопросы кардиологии. – Ростов-на-Дону. – 1989. – С. 177–178.
6. Фёдоров В. Д., Дрогайцев А. Д., Рябов Г. А. и др. Хирургические операции у больных с имплантированным кардиостимулятором // Хирургия. – 1985. – № 8. – С. 116–120.
7. ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery. A report of the Аmerican Сollege of Cardiology // Circulation. – 2007. – Vol. 116. – P. 418–500.
8. Bailey A. G., Lacey S. R. Intraoperative pacemaker failure in an infant // Can. J.Anaesth. – 1991. – Vol. 38, № 7. – Р. 912–913.
9. Bales J. G., Colon J., Ramadhyaniet U. et al. Electrocautery-induced asystole in a scoliosis patient with a pacemaker // J. Pediatr. Orthop. – 2007. – Vol. 16, № 1. – Р. 19–22.
10. Casavant D., Haffajee C., Stevens S. et al. Aborted implant- able cardioverter-defibrillator shock during facial electrosurgery // Pacing Clin. Electrophysiol. – 1998. – № 21. – Р. 1325–1326.
11. Delhumeau A., Ronceray S., Moreau X. et al. Final arrest of a pacemaker after use of electrocautery // Ann. Fr. Anesth. Reanim. – 1988. – Vol. 7, № 2. – Р. 162–164.
12. Effects of electrocautery on st. jude medical implantable cardiac pacemakers [Электронный ресурс] Режим доступа: http://cacgas.com/uploads/St_Jude_Pace_Maker_Cautery.pdf, свободный (дата обращения: 12.08.2012).
13. Erdogan O. Electromagnetic interference on pacemakers // Indian Pacing. Electrophysiol. J. – 2002. – № 2. – Р. 74–78.
14. Hayes D. L., Kay G. N., Wilkoff B. L. et al. Electromagnetic interference with implantable devices // Clin. сard. pacing and defibrillation, 3rd ed. – 2008. – P. 591–612.
15. Hayes D. L., Strathmore N. F., Ellenbogen K. A. et al. Electromagnetic interference with implantable devices // Clin. сard. pacing and defibrillation. 2nd ed. Philadelphia: Saunders, 2000. – Р. 939–952.
16. Heller L. I. Surgical electrocautery and the runaway pace- maker syndrome // Pacing Clin. Electrophysiol. – 1990. – № 13. – Р. 1084–1085.
17. Hoyt R. H., Huang S. K., Marcus F. I. et al. Factors influencing trans-catheter radiofrequency ablation of the myocardium // J. Appl. Cardiol. – 1986. – № 1. – Р. 469–486.
18. Kellow N. Pacemaker failure during transurethral resection of the prostate // Anaesthesia. – 1993. – № 48. – Р. 136–138.
Для цитирования:
Тягунов А. Е., Федотов Н. М., Сажин А. В., Первова Е. В.. Безопасность хирургических операций с использованием монополярной электрокоагуляции у пациентов с электрокардиостимулятором. Вестник анестезиологии и реаниматологии. 2013; 10 (6):39-51.
For citation:
Tyagunov A.E., Fedotov N.M., Sazhin A.V., Pervova E.V. Safety of surgery using monopolar electrocoagulation in patients with an electrocardiostimulator. Messenger of ANESTHESIOLOGY AND RESUSCITATION. 2013; 10 (6):39-51. (In Russ.)

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории
«Атлас ЭКГ при электрокардиостимуляции. Для начинающих»
