Проведена оценка работы имплантированного электрокардиостимулятора (ЭКС) у 99 пациентов в возрасте 62,4±9,6 года во время операций некардиологического профиля. При электрокоагуляционном воздействии у 9 (9,1%) больных выявлена ингибиция стимулов ЭКС, у 2 (2%) — кратковременные эпизоды неэффективной стимуляции с нарушением синхронизации, у 2 (2%) — изменение режима стимуляции. Нарушения имели кратковременный характер, зависели от продолжительности электрокоагуляции. У 4 больных выявлены эпизоды миопотенциального ингибирования, не связанные с электрокоагуляцией. Выявленные нарушения требуют тщательного обследования больных перед операцией, интраоперационного ЭКГ-контроля, ограничения по времени использования электрокоагуляции в монополярном режиме.
Ключевые слова: электрокардиостимулятор, электрокоагуляция во время хирургических операций, нарушения в работе электрокардиостимулятора.
Work of the implanted electric pacemaker (EP) was assessed in 99 patients, aged 62,4±9,6 years, during non-cardiological surgery. Inhibition of the EP stimuli was registered in 9 (9,1%) patients, short episodes of uneffective stimulation with synchronization disturbation — in 2 (2%) patients and change of stimulation regimen was registered in the same number of patients by electocoagulation. Episodes of myopotential inhibition not assotiated with electrocoagulation was registered in 4 cases. The ascertained rhythm disturbances require a thorough preoperative check-up, intraoperative ECG control and short use of monopolar electrocoagulation.
Key words: electric pacemaker, electrocoagulation
Введение
Число больных с имплантированным электрокардиостимулятором (ЭКС) составляет в мире около 3,25 млн. В России с 1996 по 2005 г. количество имплантаций ЭКС фактически удвоилось [1, 2]. Наличие у хирургического больного ЭКС ставит перед хирургом и анестезиологом ряд вопросов, связанных с риском развития нарушений в его работе [7].
Публикации по данной проблеме не позволяют сделать однозначных выводов о безопасности оперативного лечения таких больных, в них нет четких рекомендаций, касающихся особенностей предоперационной подготовки, оперативного лечения и послеоперационного ведения таких больных. До сегодняшнего дня остается открытым вопрос о безопасности применения во время оперативного вмешательства электрохирургической аппаратуры, особенно в монополярном режиме. Имеются сообщения о нарушениях в работе ЭКС при использовании электрокоагуляции (ЭК), однако не детализируются их характер, частота возникновения, опасность, меры профилактики и лечения возможных осложнений [7—9, 11, 14—17, 22]. Это послужило основанием для выполнения настоящего исследования.
Материал и методы
В клинике общей хирургии педиатрического факультета РГМУ совместно с Московским городским центром кардиостимуляции на базе ГКБ №4 в период с 2001 по 2007 г. выполнено 104 оперативных вмешательства 99 пациентам в возрасте от 52 до 89 лет. Для оценки сердечной деятельности во время операции во всех наблюдениях проводили запись электрокардиограммы (ЭКГ) по кардиомонитору, а в 18 — внутрисердечной электрограммы по каналу программатора ЭКС. Для оценки работы сердца и ЭКС непосредственно перед операцией, во время операции и в раннем послеоперационном периоде 24 пациентам проведено мониторирование ЭКГ методом Холтера [5]. Во время операции во всех наблюдениях использовали монополярный режим ЭК с мощностью до 100 Вт. Для оценки прямого повреждающего действия ЭК на сердечную ткань в зоне фиксации эндокардиального электрода проведены исследование уровня кардиотропных ферментов и оценка динамики ЭКГ на 1-е и 3-и сутки после операции у 21 больного. У 2 больных, умерших после оперативных вмешательств с использованием ЭК, выполнено гистологическое исследование эндокарда в зоне фиксации электрода.
В зависимости от вида нарушения ритма, частоты его возникновения, физической активности пациента и других факторов используется несколько режимов стимуляции. Для удобства обозначения конкретного варианта ритмовождения Американская межведомственная комиссия по заболеваниям сердца разработала аббревиатурный код. Первая буква обозначает стимулируемую камеру сердца (V— ventricle, A — atrium, D — dual — двухкамерная стимуляция). Вторая буква указывает камеру сердца, откуда воспринимается управляющий сигнал (V— ventricle, A — atrium, D — dual, О — сигнал не воспринимается ни одной из камер). Третья буква характеризует режим, в котором аппарат реагирует на спонтанную электрическую активность сердца (I —inhibited — запрещаемый, T — triggered — триггерный, D — dual — запрещаемый и триггерный, О —отсутствие способности воспринимать сигналы и реагировать на них). Таким образом, выделяют следующие типы ЭКС: АОО, VОО, AAI, ААT, VVI, VVT, VAT, VDD, DVI, DDD [3, 4, 20].
Результаты
У большинства больных на всех этапах операции мы регистрировали нормальную работу ЭКС. В зависимости от установленной программы у ряда моделей ЭКС имелись некоторые особенности функционирования. Например, при активированной функции «режим сна», которая предусматривает автоматическое уменьшение базовой частоты стимуляции во время физического покоя, частота стимуляции составляла 50 ударов в минуту (уд/мин).
Изменения в работе ЭКС при ЭК были зафиксированы нами у 12 (12,1%) больных. Эпизодическое отсутствие стимулов ЭКС в момент ЭК было выявлено у 9 (9,1%) больных.

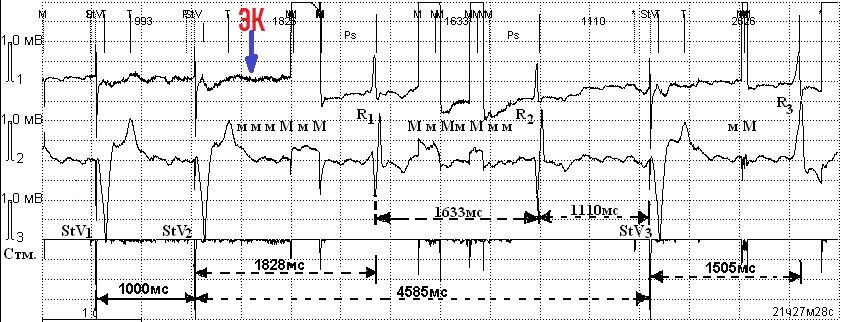
StV — монополярный желудочковый стимул с монополярной чувствительностью. Паузы до 1828 мс, 1110 мс, 4585 мс и 1505 мс с регистрацией замещающего собственного ритма с частотой 36 уд/мин (1633 мс). Коагуляционные помехи — Мм. Стм. — канал ЭКС. Скорость записи 25 мм/с, усиление 1мВ=10 мм (объяснения в тексте).
На рис. 1 представлена картина длительного воздействия ЭК на работу ЭКС в режиме VVI. Первые два желудочковых комплекса навязаны ЭКС (StV1, StV2). После StV2 на протяжении 4585 мс нет ни одного желудочкового стимула, а возникающие через 1828 и 1633 мс желудочковые комплексы R1 и R2 являются собственными желудочковыми сокращениями с частотой ритма 35 уд/мин (интервалы отмечены пунктирными стрелками). Аналогичные нарушения были выявлены на внутрисердечной электрограмме (рис. 2). Нарушение зарегистрировано у 8 (8,1%) пациентов в монополярном режиме чувствительности, в биполярном — только у 1 (1,0%).
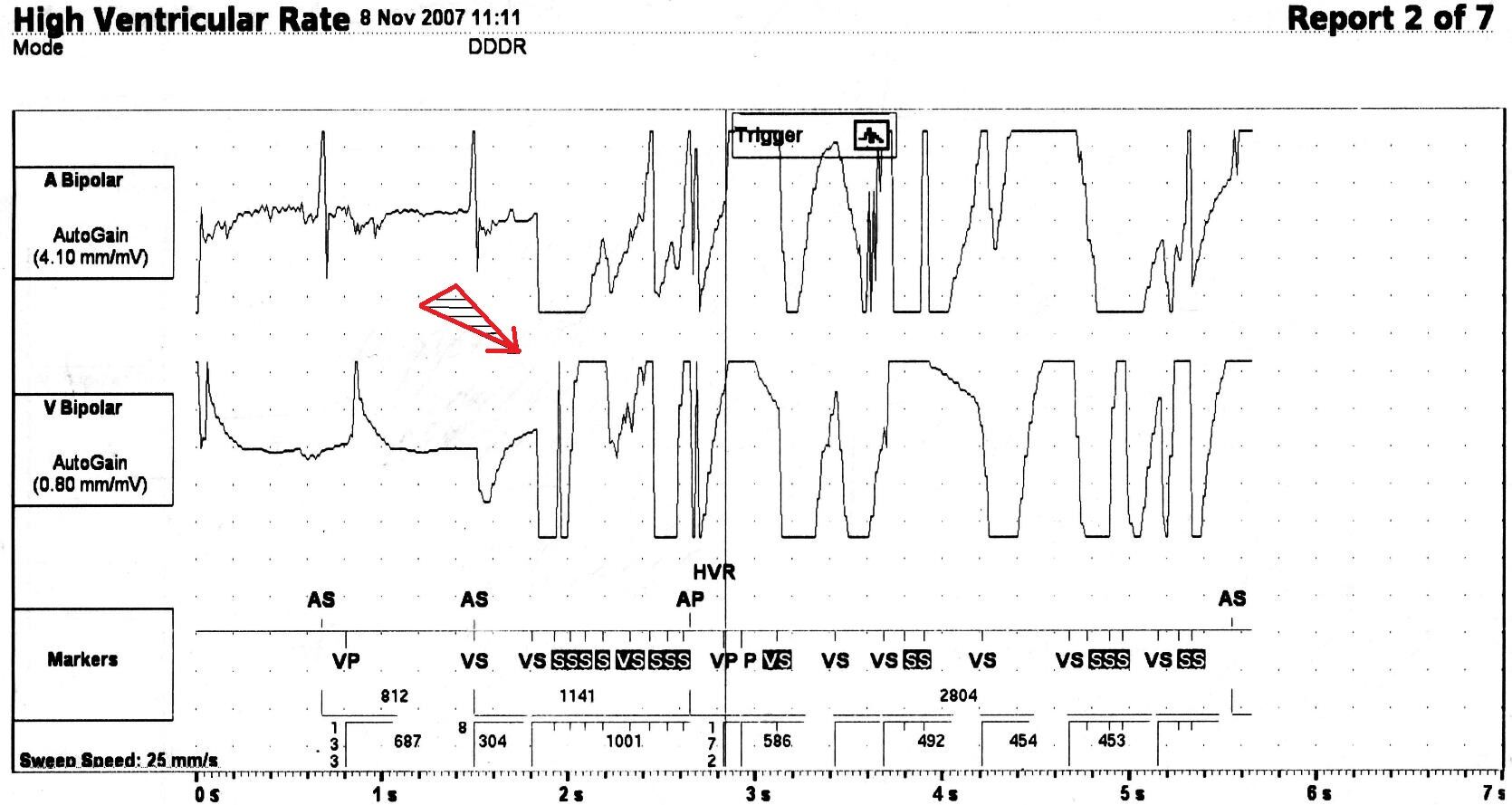
Режим стимуляции DDDR. Маркеры: AS — собственное предсердное сокращение, VS (S) — собственное желудочковое сокращение, VS — собственное желудочковое сокращение, зарегистрированное в течение рефрактерного периода канала, VP — желудочковый стимул, НVR — детекция высокой частоты желудочкового ритма. Начало коагуляции отмечено стрелкой. Скорость записи 25 мм/с.
Единичные неэффективные стимулы ЭКС во время нанесения ЭК были выявлены у 2 (2,0%) больных. На рис. 3 — двухкамерный режим стимуляции DDD. StР1—StР9 — эффективные предсердные стимулы. StV1—StV4, StV6—StV9 — эффективные желудочковые стимулы. Желудочковый StV5 не вызывает возбуждения миокарда (пауза длительностью 1726 мс).
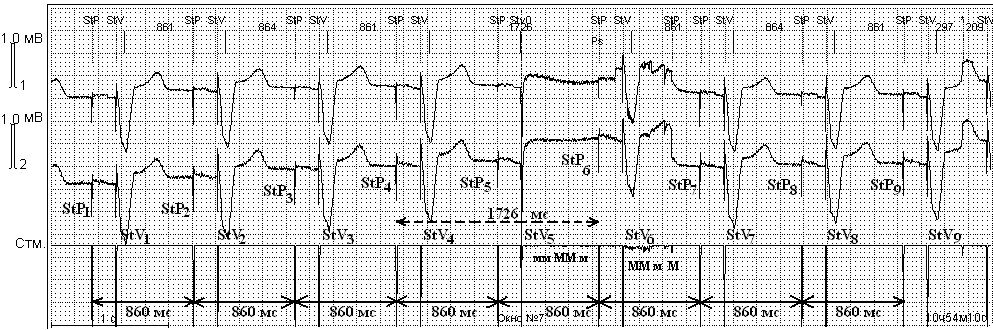
Интервал гистерезиса — не активирован. Стимулы монополярные: StP — предсердный, StV — желудочковый. В момент воздействия ЭК нарушение стимулирующей функции ЭКС по желудочковому каналу. Пауза до 1726 мс за счет выпадения желудочкового комплекса. Коагуляционные помехи — Мм. Стм. — канал ЭКС. Скорость записи 25 мм/с, усиление 1мВ=10 мм (объяснение в тексте).
У 1 (1,0%) больного под воздействием ЭК нами был зарегистрирован кратковременный переход ЭКС из исходно запрограммированного режима VVI в асинхронный режим стимуляции (VOO) (рис. 4). Вследствие этого ЭКС перестал воспринимать собственные сердечные сокращения и, несмотря на их достаточную частоту, продолжал стимуляцию. На рис. 4 наблюдается нарушение синхронизации ЭКС (StV1—StV7) с собственными желудочковыми сокращениями сердца (R1—R8).
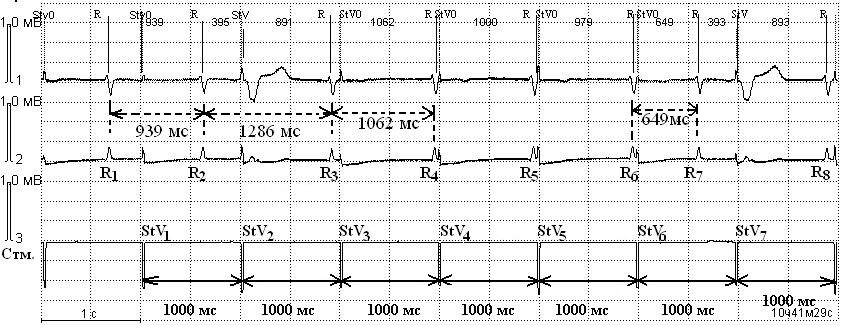
Кратковременный переход в асинхронный режим стимуляции (VOO). Конкуренция навязанного и спонтанного ритмов. Стм. — канал ЭКС. Скорость записи 25 мм/с, усиление 1мВ=15 мм (объяснение в тексте).
У 1 (1,0%) больного с двухкамерной стимуляцией (DDD) на канале Markers программатора была выявлена детекция ЭК по предсердному каналу (рис. 5) — ЭКС расценил ЭК как наджелудочковую тахиаритмию. В результате автоматического включения антитахикардитической функции (АMS — Auto Mode Switch) произошло уменьшение частоты ритма сердца, следовавшего в Р-синхронизированном режиме, со 120 уд/мин (левая часть рис. 5) до 80 уд/мин (правая часть рис. 5).
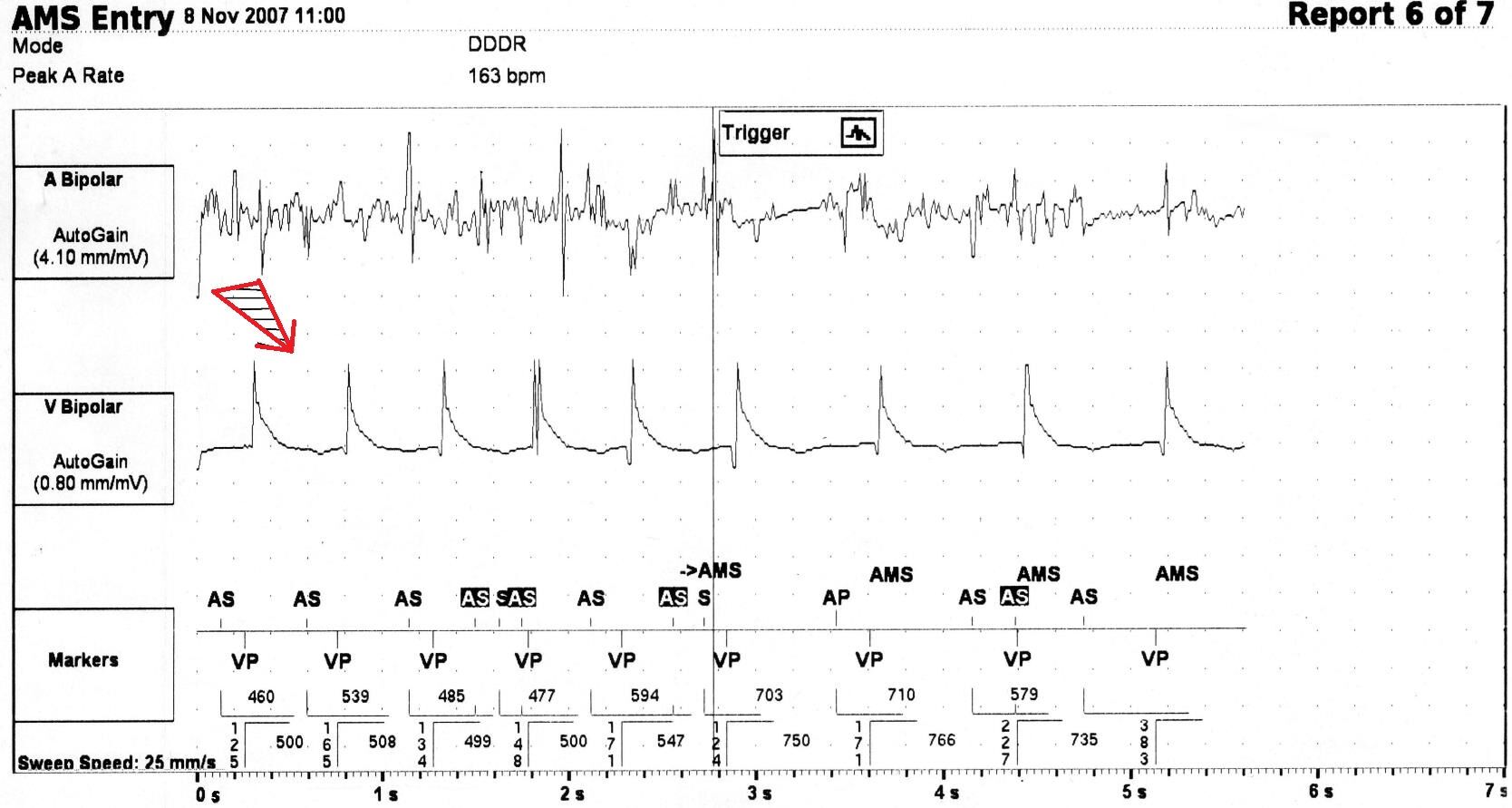
Маркеры: AS (S) — собственное предсердное сокращение, AS — собственное предсердное сокращение, зарегистрированное в течение рефрактерного периода канала, AP — предсердный стимул, VP — желудочковый стимул. Начало коагуляции отмечено стрелкой. AMS — автоматическая функция Auto Mode Switch. Скорость записи 25 мм/с.
При исследовании уровня кардиотропных ферментов и динамики ЭКГ на 1-е и 3-и сутки после операции только у 1 (4,8%) пациента на 1-е сутки после операции выявлено повышение КФК (без динамики МБ-фракции). В остальных случаях показатели не превышали нормы. Изменений на ЭКГ, в том числе и при отключении ЭКС, не зафиксировано. При патологоанатомическом исследовании ткани сердца в зоне фиксации эндокардиального электрода у 2 пациентов, умерших от острого нарушения мезентериального кровообращения в первые сутки после операции, как при макроскопическом, так и при гистологическом исследовании также не обнаружено признаков термического поражения (рис. 6).
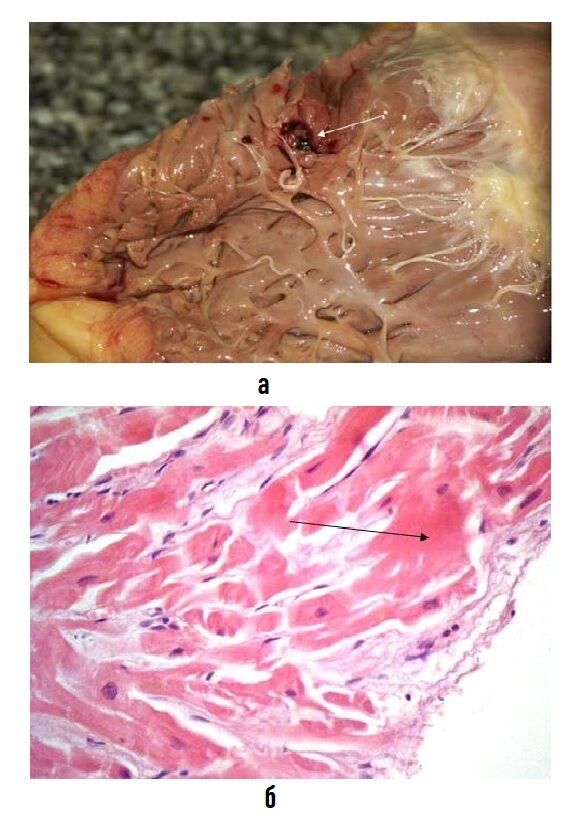
а — правый желудочек сердца. Стрелкой обозначено место фиксации эндокардиального электрода в области межжелудочковой перегородки с субэндокардиальными кровоизлияниями. Макроскопические признаки термического поражения отсутствуют;
б — миокард правого желудочка сердца в области фиксации электрода. Имеются деструкция эндокарда, интерстициальный отек и очаговое повышение сорбции красителя цитоплазмой кардиомиоцитов вследствие механической травмы при имплантации электрода. Признаки термического поражения отсутствуют (стрелка). Ув. 400. Окраска гематоксилином и эозином.
Кроме описанных выше состояний, во время операций нами были зафиксированы паузы в работе ЭКС, не связанные с ЭК. Речь идет о миопотенциальном ингибировании, которое не является истинным нарушением стимуляции, так как связано с гиперчувствительностью ЭКС к внешним воздействиям. В данной ситуации источником внешних помех явились мышцы ложа ЭКС (электрические потенциалы поперечно-полосатой мускулатуры). В левой половине рис. 7 представлена эффективная стимуляция желудочков с базовым интервалом стимуляции, равным 850 мс (70 имп/мин). Между стимулами StV5 и StV6 пауза продолжительностью 3515 мс.
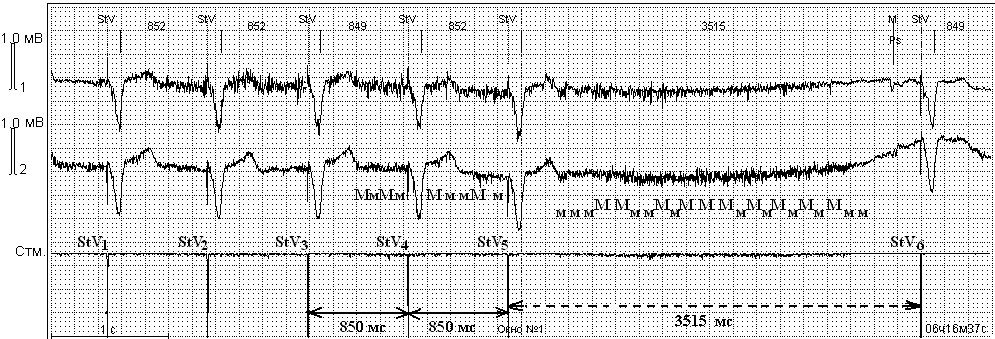
Интервал гистерезиса — не активирован. StV —желудочковый стимул ЭКС. Помехи от сокращений мышц ложа ЭКС обозначены — Мм. Пауза до 3515 мс за счет ингибирования стимуляции ЭКС. Стм. — канал ЭКС. Скорость записи 25 мм/с, усиление 1мВ=10 мм (объяснение в тексте).
Причиной асистолии явились помехи (Мм), ингибирующие работу ЭКС, воспринимаемые кардиостимулятором как желудочковые сокращения. Такие эпизоды выявлены нами при ЭКГ-мониторировании в течение предоперационного периода и во время операций только у больных с монополярной конфигурацией чувствительности ЭКС. Все нарушения в работе ЭКС, выявленные в нашем исследовании, после прекращения ЭК не регистрировались. Во время операций не возникло ситуаций, которые потребовали бы реанимационных мероприятий и вмешательств в систему ЭКС из-за нарушений в ее работе. Послеоперационная летальность составила 4,0% и не была связана с нарушениями в работе ЭКС.
Обсуждение
Особенностью современных ЭКС является их способность воспринимать электрические сигналы сердца и прекращать стимуляцию, если собственная частота сердечных сокращений становится больше запрограммированной. Электромагнитные сигналы ЭК, особенно в монополярном режиме, могут ошибочно детектироваться ЭКС как увеличение частоты сердечных сокращений. В соответствии с программой это приводит к прекращению стимуляции и, как следствие, сердечной деятельности. В первую очередь опасность асистолии при «остановке» ЭКС имеется у «стимуляторозависимых» больных — пациентов с минимальной собственной ЧСС [6, 20, 21,22]. Продолжительность данного нарушения связана с длительностью ЭК. Перепрограммирование чувствительности ЭКС с моно- на биполярную или ее уменьшение позволило уменьшить восприятие электрических помех ЭК, при этом в биполярном режиме чувствительности ЭКС был наименее подвержен воздействию ЭК.
Причина развития неэффективной стимуляции в момент монополярной коагуляции (рис. 3) неясна [12]. В литературе сообщается о «токах утечки» [18], возникающих между активным электродом электрокоагулятора и электродом ЭКС, которые оказывают термическое воздействие на ткани, контактирующие с электродом ЭКС, т.е. на эндокард желудочков или предсердий [20]. Производители ЭКС («Элестим—Кардио») указывают даже на риск повреждения ткани сердца в этой зоне при ЭК [6]. Проведенные нами анализ динамики кардиотропных ферментов и патологоанатомическое исследование не выявили прямого повреждающего действия стандартных режимов ЭК на ткань сердца в зоне контакта с электродом ЭКС, что согласуется с данными других исследователей [13]. Учитывая непродолжительность эпизодов неэффективной стимуляции и их единичный характер, можно утверждать, что они не представляют опасности как нарушение ритма ни в одной из групп пациентов. Тем не менее в момент регистрации данного нарушения нельзя исключить температурное воздействие на сердечную ткань в зоне электрода ЭКС [6]. На наш взгляд, это единственное нарушение, когда использование ЭК во время операции должно быть исключено. В литературе описан похожий феномен при использовании МРТ — выявлен нагрев электрода до 90 °С [20]. Авторы считают допустимым при необходимости использование этого исследования под контролем специалиста по электрокардиостимуляции.
Переход ЭКС из физиологического в асинхронный режим стимуляции под воздействием ЭК проявился «конкуренцией» навязанного и спонтанного ритмов сердца. Нарушение, развившееся в соответствии с программой вследствие перезапуска рефрактерного периода ЭКС, потенциально опасно при наличии преобладающей высокой частоты собственного сердечного ритма у больных. Именно при этом условии возможна его «конкуренция» с ритмом ЭКС [6]. Опасность данного нарушения заключается в развитии фатальных желудочковых нарушений сердечного ритма при попадании стимула ЭКС в «уязвимую фазу» собственного желудочкового комплекса [20]. Необходимо отметить, что вероятность возникновения таких аритмий скорее гипотетическая благодаря программированию в настоящее время низких значений амплитуды, длительности стимула, а также кратковременности данных нарушений.
Автоматическое включение функции AMS под воздействием ЭК привело к изменению частоты и режима стимуляции у одного больного. В результате осуществления данной функции мы наблюдали переход ЭКС из P-синхронизированного режима стимуляции DDD в менее физиологичный DDI с уменьшением частоты стимуляции со 120 до 80 уд/мин. В большинстве наблюдений перед операцией, вероятно, целесообразно выключение данной функции. Исключением являются пациенты с наджелудочковыми пароксизмальными нарушениями сердечного ритма, у которых эта функция во время операции позволяет оптимизировать ЧСС при их возникновении.
Феномен миопотенциального ингибирования хорошо изучен аритмологами, но как нарушение в системе ЭКС, встречающееся во время оперативных вмешательств, не описан. Принцип его развития аналогичен механизмам влияния ЭК на стимуляцию, представленным на рис. 1 и 2. Но в случае миопотенциального ингибирования кардиостимулятор принимает за собственные сокращения сердца не коагуляционные помехи, а электрические потенциалы определенных групп мышц при изменении их тонуса, например под воздействием миорелаксантов [4]. Данное проявление гиперчувствительности необходимо выявлять при оценке работы ЭКС в предоперационном периоде, а при его регистрации перепрограммировать чувствительность стимулируемой камеры ЭКС на более низкую или в биполярную конфигурацию [20].
На основании данных литературы и результатов собственных исследований мы систематизировали нарушения в работе ЭКС во время хирургических вмешательств:
I. Нарушения, не связанные с электрокоагуляционным воздействием:
миопотенциальное ингибирование.
II. Нарушения, связанные с электрокоагуляционным воздействием:
1) ингибирование стимула ЭКС [6, 20—22];
2) возникновение кратковременных эпизодов неэффективной стимуляции [12];
3) временный переход в другой режим стимуляции (VVI в VOO, DDD в DDI) с возможным изменением частоты стимуляции [6, 20];
4) повреждение электронной схемы ЭКС [15,19];
5) самопроизвольное перепрограммирование ЭКС [8, 20];
6) повреждение ткани сердца в зоне контакта с электродом ЭКС [6].
Клинические проявления нарушений в работе ЭКС во время операций зависят от частоты собственных сердечных сокращений. Чаще всего нарушения представляют опасность в группе больных с редким собственным сердечным ритмом, так называемых «стимуляторозависимых» больных (собственная ЧСС менее 30 уд/мин) — прекращение стимуляции у них ведет к критической брадикардии и асистолии. Однако больных с преобладающей нормальной частотой сердечного ритма («стимуляторонезависимых») нельзя исключить из группы риска из-за возможного возникновения конкуренции ритмов у них при переходе ЭКС в асинхронный режим стимуляции с развитием фатальных аритмий. В связи с этим для прогнозирования характера возможных клинических проявлений нарушений в работе ЭКС во время операций необходима предоперационная оценка стимуляторозависимости пациентов.
Риск развития нарушений в работе ЭКС можно уменьшить за счет оптимального расположения электродов, уменьшения силы и длительности ЭК. Электроды должны быть максимально удалены от ЭКС, амплитуда ЭК — минимальной, а ее продолжительность — не более 3 с. Хотим подчеркнуть, что только в случае полного отказа ЭКС, описанного в литературе, и только «стимуляторозависимым» больным требуется экстренная специализированная кардиохирургическая помощь. Поэтому только эту группу больных, вероятно, целесообразно оперировать в лечебных учреждениях со специализированной аритмологической службой. Остальные пациенты, даже при возникновении во время операции нарушений в работе ЭКС, в специализированной аритмологической помощи не нуждаются и при квалифицированном анестезиологическом обеспечении могут быть оперированы в общехирургических отделениях. При выполнении операции такому больному хирург и анестезиолог должны знать основные параметры его ЭКС и быть готовыми к возможным изменениям электрокардиографической картины [10]. Неподготовленного специалиста штатные изменения частоты сердечного ритма у пациентов с ЭКС во время оперативных вмешательств могут спровоцировать на неоправданное назначение лекарственных препаратов, изменение лечебной тактики или отказ от оперативного вмешательства. На большинство вопросов о модели, особенностях программы и параметрах стимуляции позволяет ответить предоперационная проверка ЭКС.
Мы считаем необходимым выделить такие задачи обследования системы стимуляции перед оперативным вмешательством:
1. Оценка основных параметров стимуляции: режима (AAI, VVI, DDD и т.д.), амплитуды, длительности импульса, порога стимуляции, полярности стимулирующего импульса и воспринимаемого сигнала, частоты магнитного теста, состояния батареи и электродов.
2. Коррекция программы ЭКС с целью выключения функций, которые могут вносить изменения в штатный режим стимуляции во время определенных этапов операции: выключение функции сенсора, автоматического определения порога стимуляции, функции сна, гистерезиса по частоте.
3. Коррекция программы, направленная на предупреждение возникновения нарушений в системе стимуляции: перепрограммирование предсердной/желудочковой чувствительности с моно- на биполярную (большинство моделей). При невозможности — программирование в режим низкой чувствительности, а у «стимуляторозависимых» пациентов — режима стимуляции на асинхронный.
4. Включение индивидуальных защитных функций, например для предупреждения проведения суправентрикулярных нарушений ритма на желудочки — включение AMS.
5. Определение стимуляторозависимости пациентов.
6. При выявлении нарушений, не корригируемых программированием, проведение хирургической коррекции системы стимуляции.
Предоперационную проверку больных, нуждающихся в плановой операции, целесообразно проводить в кардиологическом диспансере или в лечебных учреждениях, имплантировавших ЭКС. Госпитализация больных с ЭКС, нуждающихся в экстренной операции, целесообразна в лечебные учреждения, располагающие специализированной аритмологической службой. При поступлении этих больных с ЭКС в лечебные учреждения, не располагающие такой службой, во время операции нужно ограничивать использование монополярной коагуляции. Предпочтение в данной ситуации следует отдавать биполярной коагуляции или ультразвуковым методам электрохирургического воздействия.
Хотим обратить внимание на то, что порой выполнение операции больному с имплантированным антиаритмическим устройством может представлять опасность для операционной бригады. Это касается пациентов с имплантированными кардиовертерами дефибрилляторами (ИКД), так как имеется вероятность развития ситуации, представленной на рис. 2. Детекция ЭКС коагуляционных помех по желудочковому каналу в виде ложной желудочковой тахиаритмии с большой частотой желудочкового ритма [20] может привести к автоматическому нанесению разряда с запрограммированной мощностью (как правило, более 20 Дж). Поэтому на момент операции, во время которой предусмотрено использование монополярной электрокоагуляции, больным с ИКД требуется временное программное отключение функции купирования желудочковых тахиаритмий.
Заключение
Таким образом, наличие электрокардиостимулятора не является противопоказанием к выполнению операций с использованием электрокоагуляции в монополярном режиме. Изменения в работе электрокардиостимулятора могут быть связаны с воздействием электрокоагуляции или с особенностями его работы в конкретных условиях. Для прогнозирования данных изменений при предоперационном обследовании целесообразно выполнение контрольной проверки системы электрокардиостимулятора с коррекцией программы и выявлением «стимуляторозависимых» пациентов. Остальные больные под обязательным ЭКГ-контролем могут быть оперированы в общехирургических стационарах.
ЛИТЕРАТУРА
1. Базаев В.А. Электрокардиография при электрокардиостимуляции сердца // Функциональная диагностика в кардиологии. В 2-х т. / под ред.Л.А.Бокерия, Е.З.Голуховой, А.В.Иваницкого. – М.: Издательство НЦССХ им.А.Н.Бакулева РАМН, 2002. – Т.1. – С.311-333.
2. Бокерия Л.А., Ревишвили А.Ш., Ступаков И.Н., Самородская И.В. Организация медицинской помощи больным с нарушениями ритма сердца // Качественная Клиническая Практика. – 2003. – № 1. – С .75-82.
3. Бокерия Л.А., Ревишвили А.Ш., Дубровский И.А. Состояние электрокоагуляции в России в 2006 году. – Электрон. док. – Available from URL: http://www.electrophysiology.ru/library/article.php?new_article_id=23, свободный. – Заглавие с экрана. – Яз. англ. (18.01.2008).
4. Григоров С.С., Вотчал Ф.Б., Костылева О.В. Электрокардиограмма при искусственном водителе ритма сердца. – М.: Медицина, 1990. – 240 c.
5. Комплекс суточного мониторирования ЭКГ автоматизированный “Astrocard® – холтеровский анализ” (Astrocard® – Holtersystem-2F for Windows). Паспорт. – Москва: ЗАО “Медитек”. – 1996. – 39 с.
6. Костылева О.В.,Вотчал Ф.Б., Моргунов В.С. Руководство по применению имплантируемых электрокардиостимуляторов ЭКС-511 и ЭКС-530. – Тверь.: “Губернская медицина”, 1999. – 32 c.
7. Руководство. Программатор APSµ модель 3250 с версией программного обеспечения 3264а. База APSµ модель 3251 с версией программного обеспечения 3265. Sylmar, USA: St.Jude Medical; 1999. Apraxia; p. 148 (в перев.)
8. Bourke M.E. The patient with a pacemaker or related device. // Can J Anaesth. 1996; 43 (5 Pt 2): R24-41.
9. Caramella J.P., Mentre B., Jattiot F. et al. Reprogramming of a pacemaker induced by electrocautery. // Ann Fr Anesth Reanim. 1987; 6(3): 214-216.
10. Caramella J.P., Aliot E., Claude E. et al. Anesthesia and cardiac pacing. // Ann Fr Anesth Reanim. 1988; 7(4): 309-319.
11. Caramella J.P., Dodinot B. Cardiac pacemaker deprogramming by electrocautery. An update. // Ann Fr Anesth Reanim. 1989; 8(3): 290-292.
12. Chauvin M., Crenner F., Brechenmacher C. et al. In vitro study of the effects of high frequency electrical current on cardiac pacemakers. // Ann Fr Anesth Reanim.1990; 83 (7): 997-1002.
13. Chauvin M., Crenner F., Brechenmacher C. Effects of electrocautery on the threshold values of permanent pacing. An experimental study. // Arch Mal Coeur Vaiss. 1992; 85(9): 1323-1327.
14. Chauvin M., Crenner F., Brechenmacher C. Interaction between permanent cardiac pacing and electrocautery. The significance of electrode position. // PACE. 1992; 15: 2028 – 2033.
15. Delhumeau A., Ronceray S., Moreau X. Final arrest of a pacemaker after use of electrocautery. // Ann Fr Anesth Reanim. 1988; 7(2): 162-164.
16. Dreifus L.S., Fisch C., Griffin J.C. et al. Guidelines for implantation of cardiac pacemakers and antiarrhythmia devices. // J.Amer. Coll. Cardiol. 1991; 18: 1 – 13.
17. Godin J.F., Petitot J.C. STIMAREC report. Pacemaker failures due to electrocautery and external electric shock. // Pacing Clin Electrophysiol. 1989; 12(6): 1011.
18. Mangar D., Atlas G.M., Kane P.B. Electrocautery-induced pacemaker malfunction during surgery. // Can J Anaesth. 1991; 38(5): 616-618.
19. Peters R.W., Gold M.R. Reversible prolonged pacemaker failure due to electrocautery. // J Interv. Card. Electrophysiol. 1998; 2(4): 343-344.
20. Salukhe T. V., Dob D., Sutton R. et all. Pacemakers and defibrillators: anaesthetic implications. // British Journal of Anaesthesia. 2004; 93 (1): 95-104.
21. Shibata Hil-oshi, Yano M., Okahisa T.et al. Effects of High-frequency Current on Pacemakers during Endoscopic Gastric Surgery: Experimental Study. // Digestive Endoscopy 1999; 11: 150 – 157.
22. Wilson S., Neustein S.N., Camunas J. et al. Rapid ventricular pacing due to electrocautery: a case report and review. // Mt Sinai J Med. 2006; 73(6): 880-883.
Для цитирования:
Сажин А.В., Тягунов А.Е., Первова Е.В., Александров А.Н., Рогов К.А., Злотникова А.Д., Жданов А.М. Особенности общехирургических операций у больных с имплантированным электрокардиостимулятором. Хирургия. Журнал им. Н.И. Пирогова. 2010;(9):9 16.
For citation:
Sazhin AV, Tyagunov AE, Pervova EV, Aleksandrov AN, Rogov KA, Zlotnikova AD, Zhdanov AM. General surgical procedures in patients with electrical pacemaker. Pirogov Russian Journal of Surgery. 2010;(9):9 16. (In Russ.)

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории

Первова Екатерина Владимировна
- Кандидат медицинских наук
- Кардиолог-аритмолог
- Специалист функциональной диагностики высшей категории
«Атлас ЭКГ при электрокардиостимуляции. Для начинающих»
